Pharmacovigilance
SAE formulier
Alle onderzoeken hebben studiespecifieke SAE-formulieren. Deze zijn te vinden in het downloadgedeelte van de studie. Hieronder vindt u een algemene versie van de SAE-instructies die dienen als richtlijn voor het invullen van de formulieren.
SAE Instructies
We hebben een SAE-rapportagedocument opgesteld dat laat zien welke items vereist zijn op respectievelijk een eerste, een vervolg- en een definitief SAE-rapport.
SAE Reporting doc
SAE evaluatie
Op basis van een minimaal aantal gegevens kan uit een SAE worden geconcludeerd of deze kwalificeert als een Suspected Unexpected Serious Adverse Reaction (SUSAR). Om duidelijk te maken welke items voor iedereen belangrijk zijn, is er een eenvoudige tool (SAE Reporting) gemaakt voor de personen die SAE's melden. Dit document bevat de items die minimaal ingevuld dienen te worden tijdens een eerste SAE rapportage (maar ook wat we verwachten van een follow-up en een definitieve SAE).
Meestal wordt de SAE-evaluatie uitgevoerd door de "safety monitors" van de HOVON Pharmacovigilance team. In uitzonderlijke gevallen wordt soms echter besloten dat deze taak wordt uitgevoerd door de hoofdonderzoeker.
Een SAE kwalificeert als SUSAR als:
- De (S)AE-term wordt gezien als een het hebben van een ‘aanzienlijke relatie’ (considerable relationship), vergeleken met een van de onderzoeksgeneesmiddelen omdat het Investigational Medicinal Product (IMP) werd aangewezen en
- De term wordt niet genoemd in de Investigators Brochure (IB) van het gerelateerde IMP.
De relatie tussen de SAE en de medicatie moet worden beoordeeld door de hoofdonderzoeker van de site. Ziet de onderzoeker geen verband dan kan de safety monitor (in overleg met de hoofdonderzoeker) vaststellen dat er wel een relatie is. De omgekeerde situatie is niet mogelijk, men kan een relatie die aangewezen werd op de site nooit ‘downgraden’. De Pharmacovigilance team maakt gebruik van een internationaal toegepaste tool:
SAE datamanagement
Op basis van het SAE-rapport (Initial / Follow-up / Final) dat we ontvangen, kijken we of er informatie ontbreekt en of de informatie op het rapport consistent is met het protocol en de eerder gerapporteerde informatie. Als iets niet duidelijk is of als er een inconsistentie wordt vastgesteld, sturen we vragen (queries) naar de site die de SAE heeft gerapporteerd.
Er wordt onderscheid gemaakt tussen:
- Dringende vragen: Binnen 2 dagen verwachten we een antwoord. Deze vragen gaan over ontbrekende of onduidelijke onderdelen die belangrijk en nodig zijn voor het uitvoeren van de SAE-evaluatie.
- Niet-urgente vragen: binnen 14 dagen verwachten we een antwoord. Dit kan van invloed zijn op alle zaken die belangrijk zijn om een duidelijk beeld te hebben van de SAE.
Beantwoorden van queries:
De antwoorden op de e-mail met vragen kunnen bij voorkeur worden gedaan door ons een herzien SAE formulier te mailen, inclusief onze vragen. U kunt het pakket (herziene SAE incl. onze queries) het beste sturen naar de contactgegevens die bovenaan het SAE-rapport staan vermeld.
SUSAR reportage
Volgens de huidige wet- en regelgeving moeten SUSAR's worden gerapporteerd aan een aantal partijen, namelijk:
- De oordelende ethische commissie (EC)
- De bevoegde autoriteit (BA)
- The European Medicine Agency (EMA / http://www.ema.europa.eu) in de EudraVigilance Database.
- Alle lokale onderzoekers in de studie waar de SUSAR voorkomt
De HOVON Pharmacovigilance team rapporteert ook elke SUSAR aan:
- De hoofdonderzoeker,
- De hoofdonderzoeker van andere onderzoeken met datzelfde IMP in zijn / haar onderzoek (we doen dit omdat HOVON als sponsor verplicht is om deze SUSAR's te rapporteren aan de EC / CA van andere onderzoeken als ze relevant zijn voor dat onderzoek. De relevantie moet worden beoordeeld door de PI van dat onderzoek).
Lokale coördinator SAE
Voor elke studie vragen we bij het lokale contactformulier de Lokale Coördinator SAE aan.
Deze persoon ontvangt een kopie van alle SAE-vragen en SUSAR's, die de HOVON Pharmacovigilance team naar de hoofdonderzoeker (s) van de ziekenhuizen stuurt, zodat hij / zij kan zorgen voor een tijdige en correcte afhandeling.
Als u ook een lokale SAE-coördinator in uw ziekenhuis wilt zijn, stuur dan een e-mail naar de HOVON Pharmacovigilance team. Wij zullen uw verzoek dan in behandeling nemen (dit duurt meestal 2 werkdagen). Nadat uw verzoek is verwerkt, ontvangt u, maar ook de site-hoofdonderzoeker, een bericht dat u op de distributielijst staat.
Veel gestelde vragen
Het document met veelgestelde vragen (FAQ) is ontwikkeld om het aantal vragen over de SAE's te verminderen.
Zie de link naar het SD FAQ-document hieronder.
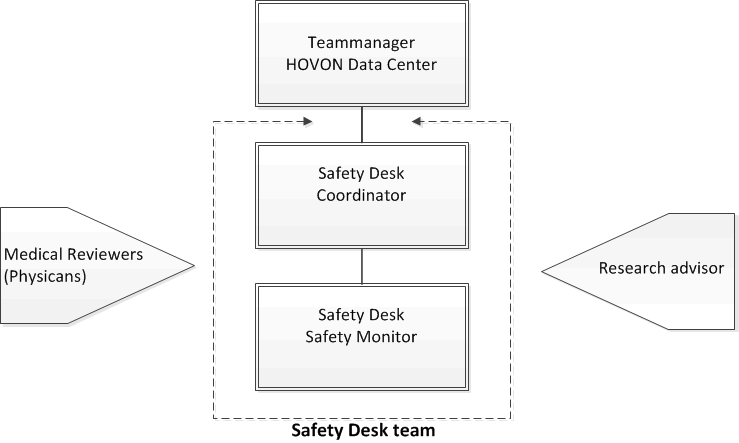
HOVON Pharmacovigilance set-up
De organisatorische opzet wordt hieronder weergegeven:
Nieuwsbrieven Pharmacovigilance
